-
Články
- Vzdělávání
- Časopisy
Nové číslo
- Témata
- Videa
- Podcasty
- Kariéra
Doporučené pozice
Reklama- Praxe
Antidiabetika v prevenci CMP
Autoři: Michal Klíma 1, 2; Aleš Tomek 2; Ondřej Škoda 1
Vyšlo v časopise: CMP jour., 7, 2025, č. 1, s. 22-25
Kategorie: Prevence
Úvod
Diabetes mellitus (DM) 2. typu je dobře známý rizikový faktor ischemické cévní mozkové příhody (iCMP) a také prediktor horšího výsledného stavu a vyššího rizika recidivy po již proběhlé mozkové příhodě [1]. Tuto skutečnost potvrzuje fakt, že pacienti s diabetem mají přibližně 2× vyšší riziko prodělání CMP než jedinci bez diabetu [2]. Nová antidiabetika však mohou toto riziko podstatně snížit a hrají tak důležitou roli v prevenci CMP.
Léčba hypertenze, fibrilace síní, karotické stenózy nebo dyslipidémie je neurologům poměrně blízká. Management léčby diabetu však často přenecháváme jiným odbornostem. Nicméně vzhledem k recentním poznatkům, tykajících se především nových antidiabetik, jež se mohou uplatnit v primární i sekundární prevenci CMP, je velmi důležité, aby se neurologové orientovali rovněž v této oblasti.
Diabetes se na vzniku CMP podílí několika mechanismy, mezi které patří makroangiopatie, mikroangiopatie a kardioembolismus.
Ateroskleróza krčních a intrakraniálních tepen se řadí mezí hlavní příčiny iCMP. Z našeho pohledu je nyní podstatné, že DM 1. i 2. typu se považuje za nezávislý rizikový faktor rozvoje aterosklerózy [4]. Hyperglykémie a inzulinová rezistence v kombinaci s dyslipidémií vytváří řadu biochemických změn, jež mimo jiné ústí v produkci LDL a konečných produktů pokročilé glykace [3]. Tyto změny působí celkově prozánětlivě a v konečném důsledku hrají významnou roli v rozvoji aterosklerotického plátu.
Hyperglykémie se také podílí na rozvoji tzv. onemocnění malých tepen (SVD – small vessel disease). Jedním z klíčových faktorů v rámci tohoto patologického procesu je zvýšení cévní tuhosti, které vede k vystavení malých cév v mozku abnormálním pulzacím [4]. Dalším faktorem je mikrovaskulární endotelová dysfunkce, jež úzce souvisí se zvýšením oxidativního stresu a zánětu, na kterém se diabetes opět signifikantně podílí [5].
V neposlední řadě je nutné zmínit fibrilaci síní (FiS), jež představuje nejčastější příčinu kardioembolismu [6]. Pacienti s DM 2. typu mají celkově o 35 % vyšší riziko FiS. Ačkoliv přesný mechanismus, kterým se diabetes podílí na rozvoji FiS vyžaduje další výzkum, i zde se předpokládá vliv konečných produktů pokročilé glykace a volných kyslíkových radikálů [7].
Možnosti léčby diabetu
Vzhledem k poměrně rychle se zvyšující incidenci diabetu [8] získává na důležitosti také správný management léčby vedoucí k celkovému snížení kardiovaskulárního (KV) rizika.
Pokud se pacient, který prodělá CMP, již léčí s diabetem, měli bychom zjistit, zda může být tato terapie dále vhodně upravena. U pacientů po CMP/TIA bez známé historie diabetu je dle doporučení AHA/ASA vhodné provedení základních screeningových vyšetření (hodnota glykovaného hemoglobinu /HbA1c/, orální glukozový toleranční test /oGTT/) [9].
Dle České diabetologické společnosti ČLS JEP je na základě algoritmu farmakologické léčby vycházejícího z konsenzu ADA/EASD lékem 1. volby metformin. Jiné antidiabetikum se použije buď při jeho intoleranci, nebo po zvážení indikace příslušné skupiny, nevyžaduje-li závažnost poruchy glykoregulace či klinický stav pacienta použít zpočátku inzulin (resp. inzulinová analoga).
Antidiabetika
V dnešní době je známo mnoho skupin používaných antidiabetik. V rámci provedených rozsáhlých studií však některé z nich prokázaly snížení KV rizika a pozitivní efekt v primární i sekundární prevenci iCMP. Jde především o agonisty receptoru pro glukagonu podobný peptid 1 (GLP-1RA), inhibitory sodíko-glukózového kotransportéru 2 (SGLT2i, tj. glifloziny) a thiazolidindiony (pioglitazon).
1. GLP-1RA
GLP-1RA řadíme mezi tzv. inkretinovou léčbu, tedy terapii využívající účinků střevního hormonu GLP-1. Mezi jejich hlavní metabolické dopady patří stimulace sekrece inzulinu, a naopak redukce sekrece glukagonu, což vede ke snížení glykémie. Receptory pro GLP-1 jsou kromě gastrointestinálního traktu (GIT) přítomné také v centrálním nervovém systému (CNS), myokardu, buňkách hladké svaloviny cév, endotelových buňkách a makrofázích.
Mechanismy, jež při jejich podávání vedou ke snížení celkového KV rizika, lze zjednodušeně popsat jako kombinaci zvýšené neuroprotekce a snížení rizika mozkové aterosklerózy [10–12]. Hlavní vliv má jednak redukce prozánětlivých složek v procesu aterosklerózy, a zároveň úprava endotelové funkce a podpora angiogeneze a neurogeneze. Na snížení rizika CMP se dále podílejí svým antihypertenzním efektem, redukcí tělesné hmotnosti, korekcí hodnot HbA1c a úpravou hladiny lipidů.
Obr. 1 Přínosy GLP-1RA v redukci rizika CMP u diabetiků 2. typu
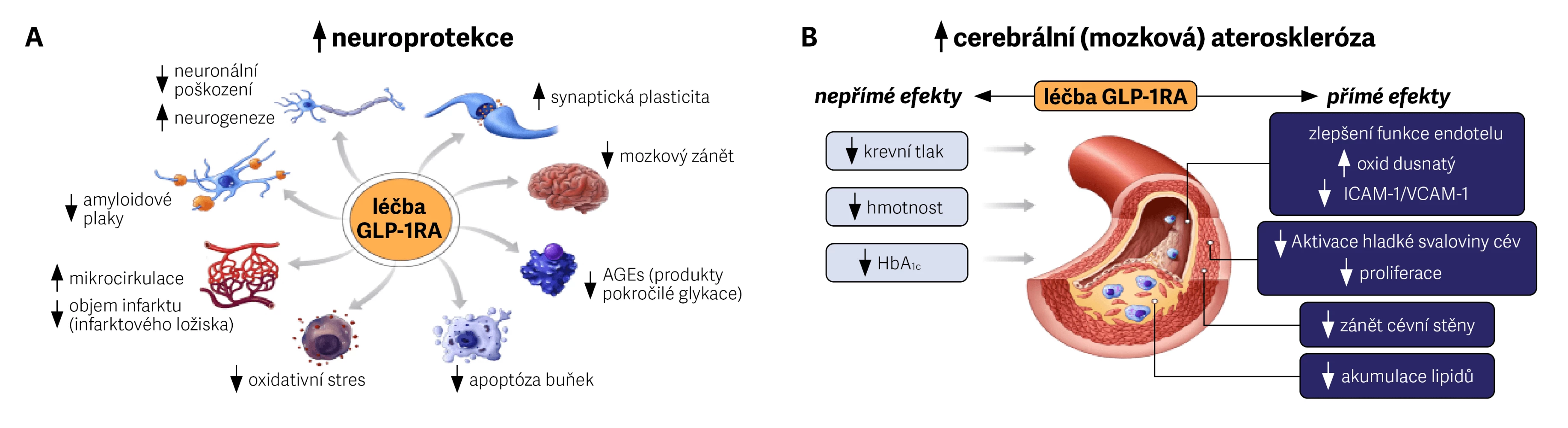
Na tomto místě je vhodné zdůraznit, že ne všechny látky ze skupiny GLP-1RA prokázaly snížení KV rizika v rámci klinických studií. Příznivý efekt byl doložen u semaglutidu, dulaglutidu a liraglutidu.
Tato data vycházejí z velkých CVOT (cardiovascular outcome trials) u pacientů s DM 2. typu s primárním endpointem MACE (závažné KV nežádoucí příhody), mezi něž patří nefatální infarkt myokardu (IM), nefatální CMP a úmrtí z KV příčin. V rámci 2 studií (REWIND a SUSTAIN6) prokázaly dulaglutid a semaglutid významný pokles jak primárního endpointu MACE, tak i předem definovaného sekundárního endpointu nefatálních CMP [13, 14]. Zatímco podávání dulaglutidu bylo provázeno snížením KV rizika o 12 % a nefatálních mozkových příhod o 24 %, semaglutid snížil KV riziko o 26 % a nefatálních mozkových příhod o 39 %. Provedené metaanalýzy CVOT s GLP-1RA odhalily statisticky významný pokles fatálních i nefatálních CMP, pokles MACE, úmrtí z KV příčin, fatálních i nefatálních IM a hospitalizací pro srdeční selhání [15].
2. Glifloziny
SGLT2i (kanagliflozin, dapagliflozin, empagliflozin, ertugliflozin a v Česku nedostupný sotagliflozin) částečně blokují reabsorpci glukózy v proximálních tubulech ledvin. Společným mechanismem působení gliflozinů je navození terapeutické glykosurie doprovázené osmotickou diurézou. Glykosurie vede k poklesu glykémie a zlepšení kompenzace diabetu.
Dostupná data vycházejí především ze studií EMPA-REG OUTCOME, CANVAS a DECLARE. Souhrnně lze říct, že byl prokázán benefit užívání SGLT2i v rámci snížení rizika MACE u pacientů s prokázanou KV chorobou [16]. Oproti tomu efekt na snížení rizika hospitalizace pro srdeční selhání a progrese renálního onemocnění byl na prokázaném KV onemocnění či srdečním selhání nezávislý.
Data, která z daných studií s GLP-1RA a SGLT2i máme, se již propsala do nejnovějších doporučení odborných společností. Z těch vyplývá, že GLP-1RA se mají zvážit u pacientů s DM, kteří jsou zároveň ve vysokém riziku nebo s již prokázaným KV onemocněním. Glifloziny potom u diabetiků se srdečním selháním a chronickým onemocněním ledvin (CKD).
3. Pioglitazon
Posledním lékem, který můžeme v této souvislosti zmínit, je pioglitazon. Tento lék je inzulinovým senzitizérem ze skupiny thiazolidindionů zvyšujícím citlivost tkání k účinku endogenního inzulinu, což vede k poklesu plazmatické hladiny glukózy. Thiazolidindiony jsou vysoce selektivními a potentními agonisty receptoru aktivovaného peroxisomovými proliferátory (PPAR) s lokalizací na jádře buněk. Tyto receptory jsou obsaženy v různých tkáních, s čímž je spojen rozmanitý efekt této lékové skupiny.
Důležitá klinická data máme především ze studie PROactive, jež prokázala snížení celkové mortality a výskytu nefatálních IM a CMP o 16 %. Dalším benefitem bylo rovněž významné snížení recidivy IM a CMP [17].
Shrnutí a závěr
V rámci provedených klinických studií a jejich metaanalýz prokázaly některé skupiny nových antidiabetik významný pokles kardiovaskulárního rizika, a mohou se tak uplatnit v rámci primární i sekundární prevence CMP. Mezi nejvýznamnější patří látky ze skupiny GLP-1RA, při jejichž podávání byl zjištěn statisticky významný pokles fatálních i nefatálních CMP. Tato terapie se tak dostala i do odborných doporučení, kdy u pacientů s diabetem a po prodělané CMP/TIA nebo v jejich vysokém riziku má být zváženo její nasazení.
Zdroje
1. Zhou Z, Lindley RI, Radholm K et al. Canagliflozin and stroke in type 2 diabetes mellitus. Stroke 2019; 50 : 396–404.
2. Kernan WN, Viscoli CM, Inzucchi SE et al. Prevalence of abnormal glucose tolerance following a transient ischemic attack or ischemic stroke. Arch Intern Med 2005; 165 : 227–233.
3. Poznyak A, Grechko AV, Poggio P et al. The diabetes mellitus – atherosclerosis connection: the role of lipid and glucose metabolism and chronic inflammation. It J Mol Sci 2020; 21 : 1835.
4. Chen R, Ovbiagele B, Feng W. Diabetes and stroke: epidemiology, pathophysiology, pharmaceuticals and outcomes. Am J Med Sci 2016; 351 : 380–386.
5. van Sloten TT, Sedaghat S, Carnethon MR et al. Cerebral microvascular complications of type 2 diabetes: stroke, cognitive dysfunction, and depression. Lancet Diabetes Endocrinol 2020; 8 : 325–336.
6. Kamel H, Healey JS. Cardioembolic stroke. Circ Res 2017; 120 : 514–526.
7. Bohne LJ, Johnson D, Rose RA et al. The association between diabetes mellitus and atrial fibrillation: clinical and mechanistic insights. Front Physiol 2019; 10 : 135.
8. IDF Diabetes Atlas. Diabetes around the world in 2021. International Diabetes Federation, Brussels, 2021. Dostupné na: https://diabetesatlas.org
9. Kleindorfer DO, Towfighi A, Chaturvedi S et al. 2021 Guideline for the prevention of stroke in patients with stroke and transient ischemic attack: a guideline from the American Heart Association / American Stroke Association. Stroke 2021; 52: e364–e467.
10. Maskery MP, Holscher C, Jones SP et al. Glucagon-like peptide-1 receptor agonists as neuroprotective agents for ischemic stroke: a systematic scoping review. J Cereb Blood Flow Metab 2021; 41 : 14–30.
11. Sharma A, Verma S. Mechanisms by which glucagon-like peptide 1 receptor agonists and sodium-glucose cotransporter 2 inhibitors reduce cardiovascular risk in adults with type 2 diabetes mellitus. Can J Diabetes 2020; 44 : 93–102.
12. Muscogiuri G, DeFronzo RA, Gastaldelli A, Holst JJ. Glucagon-like peptide-1 and the central/peripheral nervous system: crosstalk in diabetes. Trends Endocrinol Metab 2017; 28 : 88–103.
13. Marso SP, Bain SC, Consoli A et al.; SUSTAIN-6 Investigators. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016; 375 : 1834–1844.
14. Gerstein HC, Colhoun HM, Dagenais GR et al; REWIND Investigators. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet 2019; 394 : 121–130.
15. Sattar N, Lee MMY, Kristensen SL et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of randomised trials. Lancet Diabetes Endocrinol 2021; 9 : 653–662.
16. Zelniker TA, Wiviott SD, Raz I et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet 2019; 393 : 31–39.
17. Dormandy JA, Charbonnel B, Eckland DJ et al. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive study (PROspective pioglitazone clinical trial in macrovascular events): a randomized controlled trial. Lancet 2005; 366 : 1279–1289.
18. Goldenberg RM, Cheng AYY, Fitzpatrick T et al. Benefits of GLP-1 (glucagon-like peptide 1) receptor agonists for stroke reduction in type 2 diabetes: a call to action for neurologists. Stroke 2022; 53 : 1813–1822.
Štítky
Interní lékařství Kardiologie Neurochirurgie Neurologie Radiodiagnostika Urgentní medicína
Článek vyšel v časopiseCMP journal
Nejčtenější tento týden
- Open abdomen
- Co s NSTI? NPWT!
- Postižení zraku u RS: Ve hře je čas!
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Tranzitorní mozková příhoda z pohledu internisty, kardiologa a lékaře urgentního příjmu
- Tenektepláza v léčbě akutní ischemické cévní mozkové příhody – do Česka přichází nové trombolytikum
- Antidiabetika v prevenci CMP
- Lipoprotein (a) – opomíjený rizikový faktor cévní mozkové příhody
- Telemedicína a monitorování srdečního rytmu
- Využití autotrenažéru v řidičské rehabilitaci u osob se získaným poškozením mozku
- Editorial
- Využití MRI sekvence black blood pro zobrazení cévní stěny u pacientů s CMP – současné možnosti a klinický význam
- CMP journal
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Tranzitorní mozková příhoda z pohledu internisty, kardiologa a lékaře urgentního příjmu
- Lipoprotein (a) – opomíjený rizikový faktor cévní mozkové příhody
- Tenektepláza v léčbě akutní ischemické cévní mozkové příhody – do Česka přichází nové trombolytikum
- Využití MRI sekvence black blood pro zobrazení cévní stěny u pacientů s CMP – současné možnosti a klinický význam
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



